进军美国生物类似药市场,突破原研药厂的专利壁垒
进军美国生物类似药市场,突破原研药厂的专利壁垒
作为全球重磅药物排名的主力军,小分子药物逐渐被生物制药所取代,全球生物制药市场正在迅速发展。据估计,2014年生物制药市场接近2000亿美元,其中美国市场占比最大,市场占46%。
近年来,原研究制药公司面临悬崖专利问题,生物仿制药(或生物仿制药)的发展已成为一个突出的学派。根据Kelly Scientific Publication的一份研究报告,估计到2019年,50%的生物制药将面临专利到期。到2020年,美国生物仿制药市场的规模可能达到110亿美元,成为军事战场的战场。战略家。
美国是生物仿制药最具潜力的市场。作为全球专利战的主战场,专利申请和专利诉讼数量居世界前列。如何在像生物仿制药这样强调“模仿”的行业中开发类似的产品?同时,该产品可以避免专利风险,绝对是一种极其专业和巧妙的艺术。
除了技术门槛的突破外,生物仿制药公司还需要准确掌握与美国生物仿制药开发相关的法律法规。只有彻底了解游戏规则,才能突破专利门槛,抓住市场机遇,分享专利问题。它是进入美国市场的全球生物仿制药公司最关注的焦点之一。
1.“专利舞蹈” - 阻挡生物仿制药的高墙
美国医药法规有一个独特的专利链接系统,旨在鼓励市场竞争,同时保护原专利公司的专利不受侵犯。生物仿制药领域的专利连接系统受《生物制品价格竞争与创新法》(BPCIA)的管制。
根据BPCIA规定,生物仿制药公司与原制药公司发生专利纠纷时,双方必须在仿制药申请批准后,通过复杂的“专利舞蹈”程序解决纠纷。这个过程需要很长的过程。交流和协商确定第一次诉讼和诉讼的范围,一般需要8个月左右。此外,该规定还限制了当事人擅自提起确认诉讼。谈判结束后,只有原药品公司可以向仿制药公司报告,或者仿制药公司不履行法定程序;或者原药品公司收到药品公司上市前通知后收到仿制品。任何,当事人都可以开始确认诉讼。此外,原制药厂也可以向法院申请强制令,以防止仿制药在诉讼结果之前上市。美国的诉讼时间大多很长。原制药公司将利用甚至滥用诉讼拖延仿制药上市。
如果通用公司遵守上述规定,除了对产品上市时间有一定的影响外,许多通用公司还认为,BPCIA有一个清算机制,要求通用公司过度披露商业秘密信息,从而导致通用公司的商业秘密。由于外流风险极高,通用公司陷入困境。
总的来说,“专利舞”无疑为生物仿制药进入市场形成了障碍。许多仿制药公司正试图绕开专利舞蹈的做法,而安进目前正与桑德斯争论专利舞蹈计划是否是强制性的(注1)。我非常关心这个案子的进展。
2.避免专利舞蹈并充分利用美国专利审查程序
许多早期的仿制药公司,包括Sandoz,Celltrion和Hospira,在申请生物仿制药批准之前试图提起专利无效或产品侵权确认的诉讼,希望绕过专利舞蹈计划并提前解决专利问题。但是,这些诉讼被美国地方法院或联邦巡回上诉法院先后驳回。原因是法院认为生物仿制药公司无法明确计划申请BPCIA的快速审批程序,但他们不希望遵守BPCIA制定的专利游戏规则。也就是说,即使在申请批准之前,仿制药公司也不能提起确认诉讼。
但是,除了在美国解决专利纠纷之外,还有一个可以使用的专利审查制度。后者由美国专利局的专利审判和上诉委员会(PTAB)处理。
就生物类似药物而言,虽然上述条件有限,但生物仿制药公司可能会在提交批准申请之前首先向专利审判上诉委员会提交授权后审查(PGR)或多方。 Inter Partes Review(IPR)。优点是成本更经济,可能只花费诉讼费用的十分之一,而且还具有时间优势。专利审判上诉委员会通常会在收到请求人的请求后6个月内决定是否接受审判。该决定将在作出决定后12个月内进行审查。整个审核流程最多可完成18个月。诉讼时间要快得多。
2013年6月,Hospira对Janssen的促红细胞生成素(epoetin alfa)的治疗提出了多方审查请求(美国专利6,747,002),成功迫使Janssen于同年9月自愿放弃该专利。此外,2014年12月,勃林格殷格翰在Genentech(美国专利7,976,838,美国专利7,820,161,美国专利8,329,172)中提交了三项利妥昔单抗(利妥昔单抗)治疗专利,并提交了多方审查,但专利审判上诉委员会最终只接受了对US '83专利和美国'161专利半同期索赔的审查请求。还在审判中。
无论如何,美国专利审查系统为生物仿制药公司提供了相当好的工具和策略。在取消生物仿制药批准申请之前,假冒公司有机会将被动转为主动,并首先解除原药公司的专利威胁。许多原始制药公司担心这些专利最终会失效。申请人寻求复议的申请人也很常见。仿制药公司将主动攻击并帮助提高谈判优势,增加议价筹码。有商业利益。
3.专利风险控制,投资越早,您损失的就越少
生物仿制药不像小分子药物。因为它们需要数据来证明与原始药物的相似性,并且仍然进行部分临床研究,所以导致开发时间长和成本高。因此,在选题时,应引入专利风险调查机制,锁定专利和专利权人,做好专利研究,认真审查开发生物仿制药可能遇到的专利风险。否则,在药物开发的中间,发现踩踏原始专利地雷往往被迫暂停开发或延迟产品的上市时间。当损失很大时,生物仿制药公司只需要投入少量成本来实施专利风险分析操作,这可以避免巨大的未来。损失和费用。
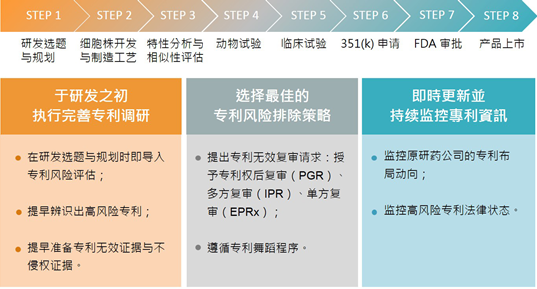
执行良好的专利研究的总体作用至少包括以下内容:首先,它可以及早识别与生物仿制药有关的高风险专利,并帮助仿制药公司制定最佳的专利风险控制策略和机制,包括应提出哪些专利。审查无效,或者如果您将来进入专利舞蹈计划,如何处理每项专利,必要时获得专利持有人的许可也是思考方式之一。其次,专利研究的实施可以帮助仿制药公司掌握特定领域的专利分配,这有利于编写专利无效审查或诉讼所需的证据组合。第三,专利信息可以为仿制药公司的发展提供药物开发技术解决方案的参考。此外,专利研究的改进也可以作为仿制药公司本身和专利布局的参考,专利被置于最关键的位置,为其他竞争者形成障碍。 (图1显示了生物仿制药开发过程和知识产权管理策略)。
最后,专利信息不断变化,新的专利申请,认证或到期可能随时可用,例如着名的Enbrel浅水船专利(注2)。因此,在不同阶段实施不同目的的专利研究后,持续更新和监测也非常重要。要实施两项主要任务:实时更新风险专利的状态,及时了解原始制药公司专利布局的新趋势。如果你能够做到以上几点,即使在像美国这样的专利战场上,你也可以管理它并赢得数千英里之外的胜利。
注1:Amgen对Sandoz的诉讼是由Sandoz开发Amgen的Neupogen造成的? (filgrastim,filgrastim)生物仿制药Zarxio?在此过程中,没有按照BPCIA专利舞蹈计划提供信息交换,因此Amgen指责Sanders违反了BPCIA。目前,此案已经进入美国联邦巡回上诉法院,并于2015年7月21日作出判决,裁定“舞蹈节目信息交换程序不是强制性的”和“180天预先 - 市场通知必须在FDA批准批准后提交“该案件仍可向最高法院上诉。
注2:原装重质生物制药Enbrel? (依那西普,依那西普),其美国专利(美国专利5,610,279)预计将于2012年到期,将失去专利保护,但安进在2011年和2012年陆续宣布两项许可证专利获得认证(美国专利号8,063,182和美国)分别为8,163,522)。由于这两项专利的申请时间是1995年5月,因此适用1995年美国专利法之前的专利期。计算方法自认证之日起17年。估计至少是Enbrel?提供额外的保护,直到2028年。这两个浅水船专利的出现使许多制造商准备开发生物仿制药没有做好准备。
原文链接:http://www.cs-vaccine.com/jiaoliuhezuo/2019/11/22/2019112218591.html

