基因疗法定价上千万 我们的支付模式如何为它买单?
基因疗法定价上千万 我们的支付模式如何为它买单?
我们正步入医疗保健的一个特殊时刻——创新的、颠覆性的基因疗法将能治愈或缓解众多疾病,而当前的市场结构并没有为其高昂的定价做好准备。
天价基因疗法
基因疗法的定价通常高达数百万美元,根据近期美国知名处方药比价网站GoodRx发布的2019年全球最昂贵药物榜单,基因疗法占据前两席。
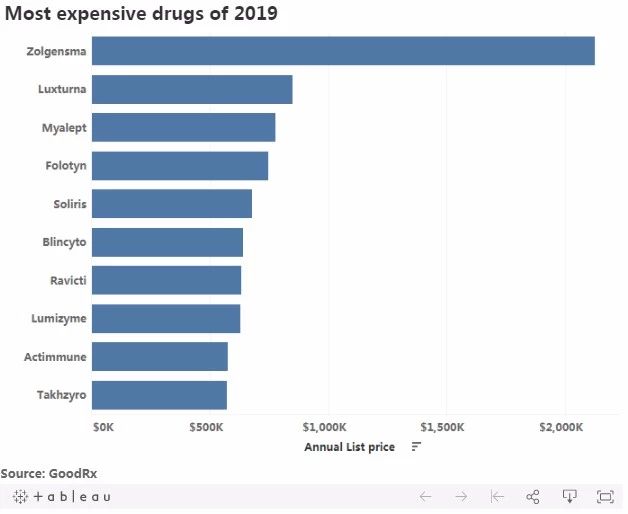
排在榜首的为今年5月24日获批的诺华用于治疗脊髓性肌萎缩症(SMA)的基因疗法——Zolgensma,目前官宣定价212.5万美元(约合人民币1460万)。
第二名为2017年12月获批的Spark Therapeutics的创新基因疗法——Luxturna,用于治疗遗传性视网膜疾病,定价85万美元(约合人民币582万)。
不过6月14日Bluebird bio公布的β-地中海贫血症基因疗法——Zynteglo的价格改写了最新排名,其定价为177万美元(约合人民币1225万),成为全球第二贵药物,也使得全球最昂贵药物前三名均为基因疗法。在可以预见的未来,这种趋势或许才刚刚开始。
现有的市场结构该如何去为这些天价疗法买单?政府经济负担、医疗保险机制、患者可获得性、社会长期收益...我们该如何去平衡这些要素?
在现有结构下,市场对基因疗法的支付呈现以下几个现象:
第一,当前的支付模式是由患者的保险公司来承担基因疗法的支付责任。
从长远来看,与终身治疗、终身护理所需的医疗成本相比,基因疗法这种“一剂即可治愈”的方式似乎确实更节省资金。根据诺华方面的说法,现有SMA疗法——百健的Spinraza,第一年治疗费用75万美元,第2年及以后每年37.5万美元,5年费用为225万美元,10年费用450万美元,而Zolgensma定价虽高,但为一次性治疗,总体比Spinraza便宜了几乎50%。
不过,这种“便宜”、“节省”事实上可能并不会归最初进行支付的保险公司所有,因为患者经常会更换保险公司。好处不能归自己所得,保险公司就很难有动力为基因疗法进行支付,他们干脆写明不覆盖基因疗法,或者通过延迟批准使用、要求高昂的成本分担等其他方式绕开支付。
第二,拥有商业保险的患者支付的治疗费用高于拥有医疗补助的患者。
一些遗传病,如镰状细胞病,大多数病人都享受医疗补助的覆盖,但这实际上会给政府、纳税人带来巨大的财政负担。Teresa L. Kauf及其同事在2009年发表的一篇论文中估计,患有镰状细胞病的人在45岁前将消耗近100万美元的医疗服务,而全美国约有7万名镰状细胞病患者,因此一款定价100万美元的基因治疗将共耗资700亿美元,而由于在人道主义上必须尽快治疗患者的原则,这一情况将在近一两年内发生,而这仅仅只是一种基因疾病治疗所产生的费用。因此,政府的预算很可能负担不起这些基因疗法。
另一方面,对单个患者而言医疗补助实际支付的费用比商业保险要少,因此制药公司倾向于向那些拥有更多商业保险的人收费。这一现象可能对私人参保者带来严重的支付承受问题。
这就引出了第三个问题,在患者不同生命时期给予的治疗将带来不同的价值。
以镰状细胞病为例,如果一开始就对子宫内或刚出生的婴儿进行基因治疗,那么就可以节省其在45岁之前的100万美元医疗费用,但如果对45岁的镰状细胞病患者进行基因治疗,其收效可能甚微,甚至无法为未来带来任何医疗资金的节约,因为在这个年龄阶段、这个病情阶段,即便基因治疗治愈了镰状细胞病,但在此前的漫长年月里,疾病已经对患者的大脑、心脏、骨骼和身体其他部位造成了严重的损害,因而还需要其他额外的昂贵治疗。
这意味着,我们需要对不同年龄阶段治疗所产生的相对价值和/或是否存在器官的不可逆损伤,做出一些判断。
第四,药企前期的高额投入由人群比例较少的患者承担。
许多基因疗法针对的是罕见病,患病人群数量较少,而制药公司前期高额的研发投入又必须在疗法专利到期之前收回,这就产生了由占人群总体比例非常小的少数患者来承担药物研发的全部高额费用的现象。
基因疗法对这些患者的合理价格应该是多少?似乎不太可能会有另外一家公司针对这么小的群体开发竞争性疗法,因此不能依靠市场竞争来降低价格。面对近乎垄断的市场,是否是药企单方面决定疗法的高昂价格?事实上,一般基因疗法的市场定价是由支付方和药企共同协商的,虽然支付方会尽可能压低药价,但考虑到前期的研发投入和必须对创新给予足够奖励和鼓励的情况,药价很难“平易近人”。
同时,有些疗法不是对每个患者都有效,或者不是对所有携带潜在治病基因的人都有效。以α-1抗胰蛋白酶缺乏症为例,这是一种可导致肺部和肝脏疾病的遗传性疾病,只遗传一种疾病基因(杂合子)的人可能永远不会发病,即便出现症状通常也都是在晚年;而在遗传了两种致病基因(纯合子)的个体中,症状出现得会更早,也更严重。因此,针对α-1抗胰蛋白酶缺乏症的治疗方法,对于纯合子患者可能有一个价格,而对于杂合子患者,根据疾病发病的可能性和严重程度,价格相对可能更低一些。
最后要考虑的一点是,一款基因疗法可能无法完全治愈疾病,只能缓解疾病,提高患者生存率、改善生存质量,这与如今热门的CAR-T疗法等肿瘤免疫治疗一样,无法确保治愈。例如,如果基因疗法只是部分有效,也许是因为治疗是在已经发生不可逆转的损害之后才介入的,该患者可能会存活下来,但其余生都需要持续的、昂贵的辅助医疗。在这种情况下,基因治疗实际上可能会增加终生护理成本,因为它提高了存活率,延长了患者的生命期,但患者仍然需要重症医疗护理。
我们在用20世纪的支付系统支付21世纪的药物
许多人对高昂的药价感到愤怒,可以想象,很少有家庭可以负担的起这些天价费用,即便有医疗补助和保险,个人需要支出的费用依然是不菲的,同时政府将承受的财政压力也将是巨大的。为什么药价会如此昂贵,为什么现有的市场支付结构会难承重压,开发这些创新药物所带来的成本是否超过了我们支付的能力?
事实上,这背后有一个更深层、更重要的问题——近年来,制药行业的科学和经济已经发生了根本性的变化,但我们支付药品的方式却没有发生变化,即我们在用20世纪的支付系统支付21世纪的药物。
20世纪,药物研发和制备相对简单 (例如降低胆固醇的他汀类药物),适用人群广泛(例如高血压人群),仿制也较为容易,因而药品上市时价格会相对低一些。相比之下,21世纪,药物研发更为复杂 (例如抗癌的个性化免疫治疗制剂),针对群体更小(例如遗传病、罕见病),仿制更为艰难,成本也往往比传统药物更高,药物的治疗过程、使用途径也更为复杂、个性化,但事实上我们的支付体系却并没有太多的变化,或者适应到能足以能应付。
因此,探索、改变是必须的。针对基因疗法的高昂定价,目前提出的一些支付方式改革大致如下:
1、订阅模式。即建立一套预先支付模式,让尽可能多的受影响患者基于这些费用可接受治疗。例如美国最大的流媒体平台Netflix的付费会员模式。在美国市场,Netflix提供基础、标准、高级三个级别的会员服务,月费分别为8美元、10美元和12美元。订阅会员可以在其影视库里任意、随时随地观看所有节目,并且没有广告。
2、承诺或拨出一定数额的钱,用于支付特定疾病的治疗,或用于支付每位患者的治疗费用。这可能是一项国际基金,因为一些国家某些疾病的患病率高于其他国家。这样,药企就可以决定投入多少资源创新才值得这笔资金奖励。
3、按时间付费模式。患者的承保公司按时间支付部分费用,而非一次性支付全部费用。它的优势在于这是一种基于价值的补偿形式,例如,假设镰状细胞病的基因治疗价格为100万美元,如前所述,如果给子宫内或刚出生的婴儿进行基因治疗,那么到45岁时就能节省100万美元的医疗费用,保险公司每年的赔付额将是100万美元除以45,约2.2万美元,如果患者在10岁时死亡,那么保险公司10年内支付的总金额约为22万美元;如果对45岁的患者进行基因治疗,而病人在一年内死亡,那么一年的费用仅为约2.2万美元。
目前诺华和Bluebird方面都表示,将提供为期5年、以结果为导向的分期付款方式来减轻患者的初期负担。5年内万一治疗无效或病患死亡,诺华会退款并向愿意签订标准化承保条款的付款人提供先期折扣。Bluebird方面,在最初的31.5万欧元预付款之后,患者如果继续对治疗有反应,则在每年(最多接下来4年)支付相同的金额。
但这一付费模式的缺点是,保险公司可能会避免为接受过基因治疗的人投保,因为保险公司将有义务对这些患者付费。
4、由医疗补助计划或其他政府项目为基因疗法买单,商业保险不必支付这些费用。即完全由公共资金来支持,社会作为一个整体来支付,而不仅仅是患者接受治疗时所归属的保险系统来支付。这就给定价留下了余地,因为这涉及到纳税人是否愿意在与个人和社会利益没有相对应关系的情况下为基因疗法付出高昂代价?
5、为治疗性基金创建或鼓励私人支付合作。疗法的费用将从所有公共和私人健康计划的通常缴费和/或保费中提取。需要基因治疗的病人将接受治疗,费用将从所有保险计划的单独帐户中支付,该帐户将专门用于基因治疗。对于每一种新疗法的开发,定价都必须反映可用资金的数量,否则基金的收入就必须增加。由于费用是由保费支付的,所有基因治疗的保险公司/使用者将获得相同的价格。
小结
目前的医疗体系及其“现收现付模式”,并不是为基因疗法这些一次性治疗建立的。我们需要新的经济模型,新的支付模式,来确定如何为这些创新疗法定价以及如何为它们提供资金,以确保社会能够支付这些治疗费用的同时,充分发挥其有益的潜力。上述这些模式也许任何一种都无法单独解决所有情况,但探索是必须的,创新如果因无力承担而被剥夺,将是一个悲剧。
参考文献
《Quest Diagnostics says 11.9 million patients’ financial and medical information may have been exposed in data breach》
《Update: Nearly 12 Million Patients Fall Victim to Quest Diagnostics' Data Breach》
《《How to protect yourself after Quest Diagnostics data breach》》
文章来源:医谷(作者 周会棋)
原文链接:https://med.sina.com/article_detail_103_1_67548.html

