重磅多发性硬化症药物:诺华芬戈莫德国内技术审评火速完成!
重磅多发性硬化症药物:诺华芬戈莫德国内技术审评火速完成!
2019年7月3日,诺华重磅多发性硬化症药物Gilenya (芬戈莫德) 已经完成技术审评,正式在NMPA启动行政审批。技术审评2个多月便火速完成,受益于国家药品监督管理局对罕见病药物审评审批政策的改革,罕见病治疗药物和临床急需境外新药中国上市进程大大提速。

截至目前,中国仅有两款多发性硬化症药物获批上市,分别为干扰素β1b、倍泰龙、以及2018年刚刚获批上市的特立氟胺。芬戈莫德中国获批仍具有特别的意义,药物将会成为国内第2款获批上市的口服多发性硬化症治疗药物,芬戈莫德的获批将会给中国多发性硬化症患者提供更多的治疗选择。
值得一提的是,诺华另一款同类作用机制的多发性硬化症药物Mayzent (siponimod,西尼莫德) 中国同样处于上市审评阶段,药物预计2019年获批上市!读者可以关注受理号JXHS1900029的审评进展!
一、芬戈莫德:重磅多发性硬化症治疗药物
多发性硬化症(Multiple Sclerosis, MS)是一种严重、终身、进行性、致残性的中枢神经系统脱髓鞘疾病,疾病列入第一批罕见病药物目录。芬戈莫德是一款S1PR调节剂,first-in-class,2010年09月率先美国获批用于复发缓解型(RRMS)多发性硬化症患者。RRMS是多发性硬化症的最主要的临床分型,占比85%!
“芬戈莫德给RRMS带来显著临床获益”
1、芬戈莫德 vs 安慰剂显著改善患者症状
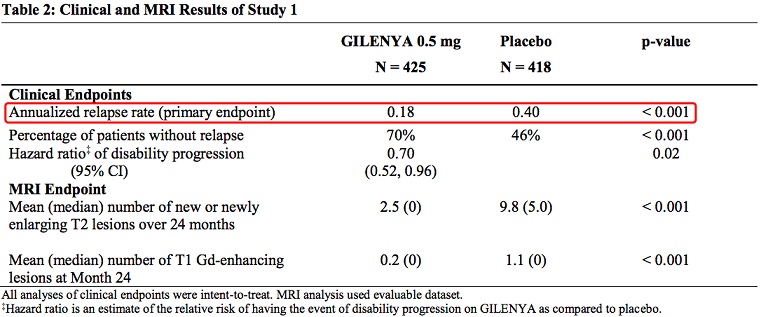
NCT00289978是支持芬戈莫德上市的注册临床试验之一,即Full Prescribing Information中所提到的 study 1,数据显示,芬戈莫德 vs 安慰剂,年化复发比例为0.18 vs 0.40,p < 0.001芬戈莫德能够显著改善多发性硬化症患者临床症状,降低成年患者复发风险。
study 1关键临床数据
2、芬戈莫德 vs 干扰素β-1a
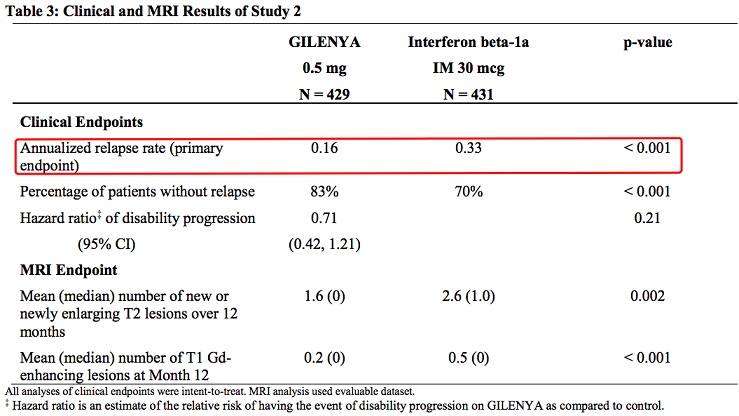
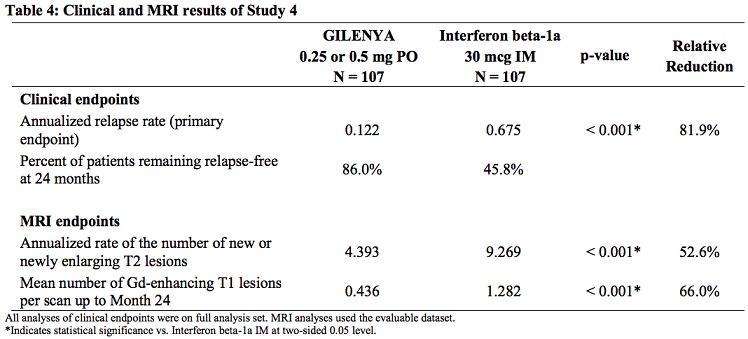
study 2 (NCT00340834)和 study 4 (NCT01892722) 是另外2项关键临床试验,study 2 和 4分别证实,芬戈莫德 vs INF beta-1a能够分别给RRMS成人和青少年患者带来显著的临床获益,相比干扰素β-1a,芬戈莫德进一步显著降低患者复发风险,减缓患者疾病进程。具有更好的依从性和临床获益!
成人患者临床数据:
青少年患者临床数据:
芬戈莫德上市后成长为一款重磅炸弹
芬戈莫德,商品名Gilenya,诺华Gilenya上市后的表现可圈可点,2018年销售额达到33.41亿美元,成为一款销售额仅次于Tecfidera的重磅炸弹,但是近年Gilenya的销售天花板逐步显现,药物市场销售额在迅速趋缓。多发性硬化症市场,罗氏Ocrevus由于其更优的临床收益和依从性,正在急速成长!

诺华2019年刚刚获批上市的同类作用机制药物siponimod可谓是Gilenya的继承者,诺华希望siponimod能够接力Gilenya,再续传奇,进一步稳固诺华在多发性硬化症市场的地位。
二.芬戈莫德中国上市的重要意义
根据《多发性硬化患者生存报告(2018)》所提及的,中国多发性硬化症的治疗现状非常差,多发性硬化症尚无有效的根治疗法,临床上仍旧以疾病修正治疗(Disease-modifying treatments ,DMT)为主。但是,截至目前,中国国内可用的多发性硬化症药物仍旧非常缺乏,负担重且药物可及性极差是一个突出问题。
很明显,口服药物芬戈莫德以及2019年西尼莫德中国获批将会进一步增加多发性硬化症患者用药选择,提高药物可及性。
但是,这仍旧不够,国家应该从多发方面进一步改善多发性硬化症患者的诊疗环境:
- 提高疾病诊断和知晓率,这一点目前国内仍旧十分落后
- 加快更多多发性硬化症创新药物的国内上市进程,如罗氏Ocrevus
- 改善患者支付能力,降低患者的医疗负担,不仅有药可用,而且药物真正可及!
三.临床优效、依从性好的药物将成为未来主流
截至目前,算上2019年刚获批上市的Mayzent (siponimod,西尼莫德),以及即将获批上市的diroximel fumarate 和 ozanimod,全球总计有16款多发性硬化症药物可用。
多发性硬化症主要药物市场销售额(亿美元)

备注:Zinbryta已退市
全球销售数据看,多发性硬化症药物中:
干扰素类产品,如Avonex,Rebif等,正在被依从性更好,临床疗效更优的口服药物和单抗药物代替,干扰素类产品市场份额近年也在持续下跌;
罗氏Ocrevus(奥瑞珠单抗)是一款里程碑式药物,开启了一个新的多发性硬化症治疗新时代,依从性和患者临床收益大幅增加,市场份额也在急速扩大。
事实上,中国跟全球多发性硬化症诊疗水平差距很大,由于国内审评审批政策改革,罕见病用药和临床急需用药的国内可及性将会明显改善。
文章来源:新浪医药新闻
原文链接:https://med.sina.com/article_detail_103_2_68364.html
